Anvisa alerta para pancreatite por uso indevido de canetas antiobesidade
A Anvisa emitiu hoje um alerta sobre os riscos do uso indevido de canetas antiobesidade. O alerta cita especificamente o risco de eventos adversos graves, como pancreatite aguda.

O que aconteceu
A Anvisa identificou crescimento nas notificações de suspeitas de pancreatite relacionadas ao uso de canetas antiobesidade no Brasil desde 2020. Apesar do alerta, não houve mudança na relação de risco e eficácia dessas substâncias. “Os benefícios terapêuticos ainda superam os efeitos adversos, de acordo com as indicações e modos de uso aprovados e constantes da bula”, explica a agência.

Casos brasileiros investigados ocorreram entre 2020 e 2025. Em nota ao UOL, a Anvisa confirmou que recebeu, entre janeiro de 2020 e dezembro de 2025, 145 notificações de suspeitas de pancreatite possivelmente relacionadas ao uso de medicamentos conhecidos como “canetas emagrecedoras”. Os casos recebidos variam entre pancreatite, pancreatite aguda, pancreatite crônica, pancreatite necrosante e pancreatite obstrutiva, diz o órgão.
Dentro desse total, seis registros tiveram desfecho suspeito de morte, segundo dados encaminhados pelo órgão ao UOL. A agência reforça que não é possível afirmar relação causal direta entre os medicamentos e as mortes, já que os casos se baseiam em notificações espontâneas. Segundo a agência, “o uso indiscriminado e fora das indicações autorizadas, especialmente para emagrecimento sem necessidade clínica, eleva significativamente o risco de efeitos adversos e dificulta o diagnóstico precoce de complicações graves”.
Há ainda mais casos suspeitos relatados após estudos científicos. As informações constam no VigiMed, sistema oficial de farmacovigilância da Anvisa, que reúne relatos feitos por profissionais de saúde, pacientes e fabricantes sobre possíveis eventos adversos associados ao uso de medicamentos. De acordo com o órgão, quando são incluídos também dados provenientes de pesquisas clínicas, o número total de notificações de pancreatite no período analisado sobe para 225 registros.

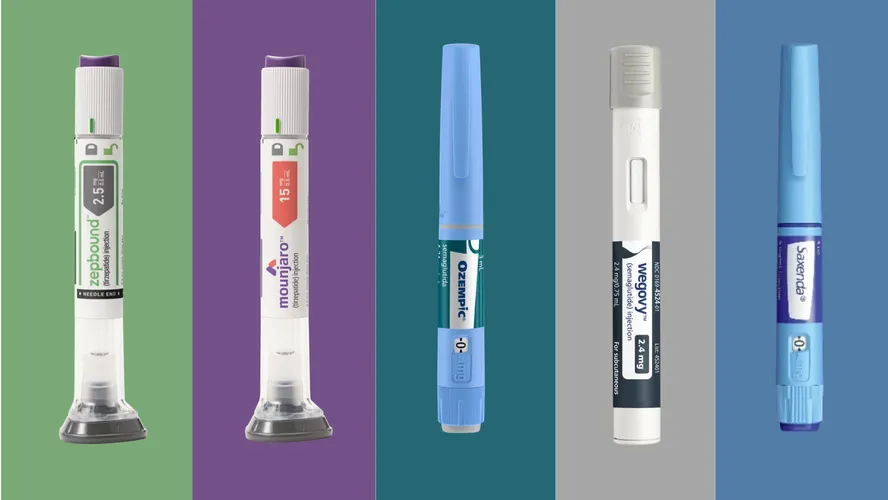
A apuração considerou relatos envolvendo os princípios ativos semaglutida, liraglutida, dulaglutida e tirzepatida. Todos são utilizados no tratamento de obesidade e diabetes tipo 2. Em parte das notificações, os medicamentos aparecem identificados apenas pelo nome do princípio ativo, o que dificulta a vinculação direta aos nomes comerciais no painel público de dados.
A análise mostra aumento contínuo das notificações ao longo dos anos. Em 2020, houve apenas um registro. O número subiu para 21 em 2021; 23 em 2022; 27 em 2023; e 28 em 2024. Já em 2025, foram contabilizadas 45 notificações, representando alta superior a 60% em relação ao ano anterior.
“Do total de notificações recebidas com os eventos de pancreatite citados, seis foram reportadas com desfecho suspeito de óbito pelo notificador [nome comercial do medicamento]”, explica a Anvisa ao UOL. O órgão ainda destaca que nem todos os relatos trazem dados completos, como histórico clínico detalhado, comorbidades ou uso concomitante de outros medicamentos, o que impede conclusões definitivas.
Risco já descrito em bula
A agência reguladora ressaltou que a possibilidade de pancreatite já está descrita nas bulas desses medicamentos no Brasil, como evento adverso conhecido, ainda que considerado incomum. Em abril de 2025, diante do crescimento do uso desses produtos, a Anvisa passou a exigir retenção da receita médica para a venda das canetas como forma de reforçar o controle e o uso seguro.
A Agência recomenda que pessoas que usam esses medicamentos procurem atendimento médico imediato, em caso de dor abdominal intensa e persistente, que pode irradiar para as costas e vir acompanhada de náuseas e vômitos — sintomas sugestivos de pancreatite. “Os profissionais de saúde devem interromper o tratamento, ao suspeitar da reação, e não dar prosseguimento, caso o diagnóstico seja confirmado”, informa a agência.
As informações sobre possíveis efeitos adversos variam entre os medicamentos. A bula do Mounjaro aponta a doença aguda da vesícula biliar como um efeito colateral comum, com ocorrência em até 10% dos pacientes. Nesses casos, há inflamação provocada pela obstrução do ducto biliar por cálculos. Já a pancreatite aguda (inflamação no pâncreas) surge no documento como reação incomum (ocorrendo entre 0,1% e 1% dos pacientes que utilizam este medicamento).
Pancreatite (inflamação do pâncreas) aguda: Mounjaro não foi estudado em pacientes com histórico de inflamação no pâncreas e deve ser utilizado com cautela nesses pacientes. Se você estiver com suspeita de pancreatite e em tratamento com Mounjaro, informe ao seu médico e interrompa o tratamento. […] Se houver a confirmação de pancreatite, Mounjaro não deverá ser reiniciado.
– Bula do Mounjaro
Matéria completa no UOL